Εισαγωγή
Ο νευροπαθητικός πόνος (ΝΠ) οφείλεται σε πρωτογενή βλάβη των νευρικών στοιχείων και εκδηλώνεται με υπεραλγησία και αλλοδυνία. Ο νευροπαθητικός πόνος στον γενικό πληθυσμό εκτιμάται ότι έχει επιπολασμό που κυμαίνεται μεταξύ 3% και 17%. (1) Ο ΝΠ προκαλείται από κεντρικά και περιφερικά αίτια. Στα κεντρικά αίτια συγκαταλέγονται τα Αγγειακά Εγκεφαλικά Επεισόδια (ΑΕΕ), οι συμπιεστικές, εκφυλιστικές και τραυματικές μυελοπάθειες καθώς και η Σκλήρυνση κατά Πλάκας (ΣκΠ). Τα περιφερικά αίτια μπορεί να είναι λοιμώδη (HPV λοίμωξη, Πολιομυελίτιδα), μεταλοιμώδη (μεθερπητική νευραλγια, Συνδρ. Guillian Barre), τραυματικά – εκφυλιστικά (τραύμα ΝΜ, συμπίεση, εκφύλιση δίσκου), μεταβολικά (διαβητική νευροπάθεια, αλκοολική νευρίτιδα, ανεπάρκεια βιταμινών), φαρμακευτικά – χημικά (χημειοθεραπεία, αλκόολ, βαρέα μέταλλα) καθώς και ρευματολογκά – μυοσκελετικά (παρετική ισχιαλγία, αυχενικό σύνδρομο κα). (2,3)
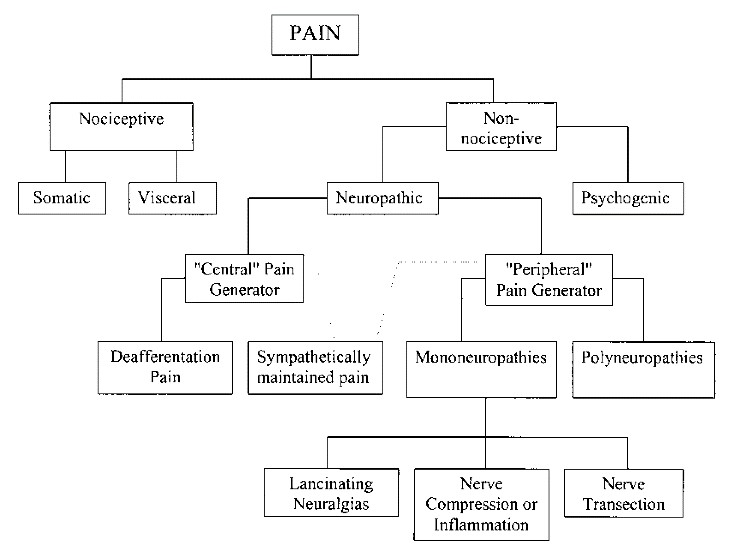
Τα κλινικά σημεία και συμπτώματα του νευροπαθητικού πόνου ανάλογα με τον τρόπο που παράγονται και εμφανίζονται διαχωρίζονται σε α) Συμπτώματα Ηρεμίας (αυτόματα) και β) προκλητά – επαγόμενα συμπτώματα. Στα αυτόματα συμπτώματα εντάσσονται οι παραισθησίες/δυσαισθησίες, οι καυσαλγίες, ο παροξυσμικός- διαξιφιστικός πόνος, ο πόνος τύπου ηλεκτρικού ρεύματος, η υπαισθησία, η μυϊκή ατροφία και οι δεσμιδώσεις καθώς και ειδικότερη νευρολογική σημειολογία (χορειοαθετωσικές κινήσεις, μυοκλονίες κα.). Στα προκλητά συμπτώματα εντάσσονται η αλλοδυνία και η υπεραλγησία με αποτέλεσμα ο ασθενής να πονά σε ανώδυνα ή φυσιολογικά ερεθίσματα. Άλλες εκδηλώσεις που σχετίζονται με τον ΝΠ είναι η αρθρική δυσκαμψία, η μυϊκή αδυναμία και ατροφία καθώς και μεταβολές στην εφίδρωση, τη θερμοκρασία και το χρώμα του δέρματος και τριχόπτωση. (4)
Η διάγνωση του ΝΠ είναι κλινική. Οι κλίμακες μέτρησης πόνου (αριθμητικές, λεκτικές, χρωματικές) είναι χρήσιμες για τη διάγνωση και παρακολούθηση του ΝΠ. Η θεραπεία του ΝΠ δεν είναι άρτια λόγω της ελλιπούς κατανόησης της αιτιοπαθογενετικής του βάσης. (5)
Σκοπός αυτής της εργασίας είναι να παρουσιάσει νέες θεραπευτικές προσεγγίσεις με έμφαση στη συντηρητική – φαρμακολογική αντιμετώπιση του πόνου και ειδικότερη αναφορά στο ρόλο της PEA.
Μέθοδος
Έγινε ανασκόπηση της βιβλιογραφίας με λέξεις κλειδιά (neuropathic pain, treatment, palmitoylethanolamide) στις βάσεις Pubmed και Google Scholar. Κριτήρια εισαγωγής ήταν η ημερομηνία δημοσίευσης των μελετών (2000 και εξής) και η διαθεσιμότητά τους στα αγγλικά ή τα ελληνικά. Κριτήριο αποκλεισμού ήταν η αναφορά σύγκρουσης συμφερόντων.
Αποτελέσματα
Σύμφωνα με τη βιβλιογραφία οι περισσότερες από τις διαθέσιμες θεραπείες για το νευροπαθητικό πόνο έχουν μέτρια αποτελεσματικότητα και παρουσιάζουν παρενέργειες. Κλασικά χρησιμοποιούνται αντικαταθλιπτικά (τρικυκλικά αντικαταθλιπτικά – αμιτριπτυλίνη, νορτριπτυλίνη δεσιπραμίνη, αναστολείς υποδοχέων επαναπρόσληψης σεροτονίνης – δουλοξετίνη, βενφλαμίνη), οπιοειδή (τραμαδόλη, ταμπεντανόλη) και αντιεπιληπτικά φάρμακα (gabapentin, pregabalin).
Τα αποτελέσματα των αντικαταθλιπτικών είναι ικανοποιητικά ως προς τη μείωση του πόνου και την αντιμετώπιση των ψυχοκοινωνικών προβλημάτων (απόσυρσης) των ασθενών. Εν τούτοις η καθυστερημένη έναρξη της δράσης τους (6-8 εβδομάδες από την έναρξη της θεραπείας) και οι ανεπιθύμητες ενέργειές τους (δυσκοιλιότητα, αύξηση βάρους, στυτική δυσλειτουργία κα) επιδρούν αρνητικά στη συμμόρφωση των ασθενών. (7)
Τα οπιοειδή (τραμαδόλη, ταπεντανόλη) εμφανίζουν υψηλή αποτελεσματικότητα στη μείωση του χρόνιου ή νευροπαθητικού πόνου σε βραχυπρόθεσμη χορήγηση. Μεσοπρόθεσμη χορήγηση τους έχει συνδεθεί με μεγαλύτερη αποτελεσματικότητα από placebo αλλά και συχνότερες ανεπιθύμητες ενέργειες (εξάρτηση, ναυτία, έμετος, δυσκοιλιότητα, κεφαλαλγίες). Παράλληλα οι συγγραφείς συστηματικής ανασκόπησης Cochrane τονίζουν ότι ο πληθυσμός των ασθενών στις σχετικές μελέτες ήταν περιορισμένος ενώ δεν λήφθηκαν υπόψιν τα προβλήματα συμμόρφωσης ή κατάχρησης των φαρμάκων αυτών που απαντώνται στην καθημέρα κλινική πράξη. Ως εκ τούτου φαίνεται ότι η θεραπεία του νευροπαθητικού πόνου με οπιοειδή είναι καλύτερο να εξατομικεύεται και να μην παρατείνεται επί μακρόν (8)
Σε σχέση με τα αντιεπιληπτικά, έχει βρεθεί ότι μόνη η gabapentin και η pregabalin συμβάλλουν ικανοποιητικά στη μείωση του νευροπαθητικού πόνου. Περιορισμένα στοιχεία υπάρχουν για τη λαμοτριγίνη. Οι ανεπιθύμητες ενέργειες των αντιεπιληπτικών (καταστολή, οιδήματα, αύξηση βάρους) είναι η σημαντικότερη αιτία διακοπής/κακής συμμόρφωσης της θεραπείας. (9)
Αρκετές μελέτες υποστηρίζουν την αποτελεσματικότητα των παραγώγων της κάνναβης. Τα φάρμακα αυτά προσφέρουν μικρή αλλά στατιστικά σημαντική μείωση του αναφερόμενου πόνου, βελτίωση του ύπνου και της ποιότητας ζωής των ασθενών. Ωστόσο δεν υπάρχει συμφωνία όσον αφορά τα σκευάσματα και τις δοσολογίες ενώ εκφράζονται ανησυχίες σχετικά με τις μακροπρόθεσμες νευροψυχολογικές επιπτώσεις της χρήσης τους. (10)
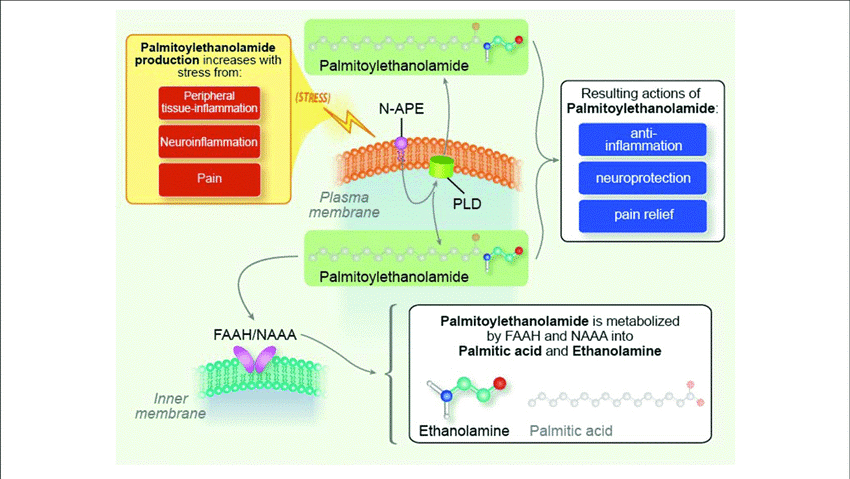
Οι NMDAR ανταγωνιστές θεωρείται επίσης ότι μπορούν να αξιοποιηθούν, παρότι σε ορισμένες μελέτες έχουν χαμηλή αποτελεσματικότητα ή μη ανεκτές ανεπιθύμητες ενέργειες. Νεότερες θεραπευτικές προσεγγίσεις εστιάζουν α) στη χρήση της νανοτεχνολογίας για τη βελτίωση της βιοδιαθεσιμότητας των φαρμάκων β) την αξιοποίηση αντιδιαβητικών ή αντιλιπιδικών παραγόντων (μετφορμίνη, σιμβαστατίνη) γ) την αξιοποίηση φυσικών συστατικών ή παραγώγων τους με αντιοξειδωτικές και αντιφλεγμονώδεις ιδιότητες. (2,4)Το PEA είναι μία ενδογενής ουσία με τροποποιητική δράση επί των μαστοκυττάρων και της νευρογλοίας σε αντίθεση με άλλες δραστικές ουσίες. (6) Χημικά η PEA εντάσσεται στην οικογένεια των Ν – ακυλεθανολαμιδών. Η αντιφλεγμονώδης δράση της PEA έγινε για πρώτη φορά αντιληπτή το 1950 και έκτοτε προκλινικές και κλινικές μελέτες έχουν καταδείξει τόσο την αποτελεσματικότητά της στην αντιμετώπιση του εκζέματος, του πόνου και της νευροεκφύλισης όσο και το ασφαλές της χορήγησης της. (11,12)
Έχουν δημοσιευθεί τουλάχιστον 21 κλινικές μελέτες που εξετάζουν τη χορήγηση της PEA ως αναλγητικού σε δόσεις από 300 μέχρι και 1200mg ημερησίως και για διάστημα από 2 ως 16 εβδομάδες. Στις περισσότερες περιπτώσεις χορηγήθηκαν ταμπλέτες ενώ σε λίγες μελέτες χρησιμοποιήθηκαν υπογλώσσια δισκία PEA. Η αποτελεσματικότητα της αξιολογήθηκε με βάση οπτική κλίμακα πόνου (Visual Analogue Scale – VAS). (10) Πρόσφατη (2016) μεταανάλυση των Paladini et al (13) που συμπεριέλαβε 12 κλινικές μελέτες τεκμηρίωσε την αποτελεσματικότητα και την ασφάλεια της PEA ως αναλγητικού.
Τα δεδομένα σχετικά με την αποτελεσματικότητα και την ασφάλεια της PEA στην αντιμετώπιση του νευροπαθητικού πόνου προέρχονται από μελέτη των Gatti et al οι οποίοι τη χορήγησαν σε σύνολο 610 ασθενών με νευροπαθητικό ή χρόνιο πόνο είτε ως μονοθεραπεία είτε σε συνδυασμό με άλλα φάρμακα. (11)
Τα τοπικά επιθέματα λιδοκαΐνης ή καψαϊκίνης συνιστώνται ως φάρμακα δεύτερης γραμμής σε ασθενείς με περιφερικό νευροπαθητικό πόνο. Η δράση τους έγκειται στην τοπική μείωση της αυθόρμητης έκτοπης έκκρισης νευρικών ώσεων με αποτέλεσμα μετρίαση του πόνου.
Άλλη φαρμακευτική επιλογή αποτελεί η νευροτοξίνη botulinum (BTX-A), η οποία περιλαμβάνεται ως θεραπεία τρίτης γραμμής στην αντιμετώπιση του νευροπαθητικού πόνου. Είναι μια ισχυρή νευροτοξίνη που χρησιμοποιείται συνήθως για τη θεραπεία της σπαστικότητας, με βάση την ικανότητά της να αναστέλλει τη συναπτική εξωκυττάρωση και επομένως τη νευρική μετάδοση. Η υποδόρια ένεση BTX-A έχει αποδειχθεί ότι είναι αποτελεσματική σε ασθενείς με εστιακό περιφερικό νευροπαθητικό πόνο και αλλοδυνία. Η BTX-A σύμφωνα με τις συστάσεις της Special Interest Group of Neuropatrhic Pain (NeuPSIG) θα πρέπει να χρησιμοποιείται ως η τελευταία επιλογή σε ανθεκτικές περιπτώσεις για περιφερικό νευροπαθητικό πόνο (5).
Μη φαρμακολογική αντιμετώπιση
Μια άλλη μη φαρμακολογική στρατηγική αντιμετώπισης του νευροπαθητικού πόνου αποτελούν τα νευρολυτικά μπλοκ, τα οποία συνίστανται στον σκόπιμο τραυματισμό ενός νεύρου με ψύξη (κρυοθεραπεία) ή θέρμανση (καυτηρίαση με ραδιοσυχνότητες RFA) ή εφαρμογή χημικών ουσιών που προκαλούν προσωρινό εκφυλισμό των στοχευμένων νευρικών ινών, με αποτέλεσμα διακοπή στη μετάδοση του νευρικών σημάτων.
Τα νευρολυτικά μπλοκ αντιπροσωπεύουν τη φυσική εξέλιξη της νευροτομίας που είναι η χειρουργική προσέγγιση για τη θεραπεία του νευροπαθητικού πόνου (ολική ή μερική εκτομή ενός νεύρου), και η οποία πραγματοποιείται σε μικρά περιφερικά νεύρα που είναι αποκλειστικά αισθητικά. Έχει χρησιμοποιηθεί με επιτυχία για τη θεραπεία της νευροπάθειας του τριδύμου, του συνδρόμου πυελικού πόνου και άλλων επώδυνων καταστάσεων. Ωστόσο, επειδή η χειρουργική τομή ενός νεύρου μπορεί να προκαλέσει με την πάροδο του χρόνου επώδυνο νεύρωμα ή διαφοροποίηση, οι νευρολυτικές προσεγγίσεις προτιμώνται συνήθως έναντι των χειρουργικών μπλοκ.
Τα περιφερικά νεύρα, τα συμπαθητικά γάγγλια και οι ραχιαίες ρίζες είναι όλα πιθανοί στόχοι για νευρόλυση. Τα νευρολυτικά μπλοκ έχουν εφαρμοστεί με επιτυχία σε ασθενείς με ανθεκτικό νευροπαθητικό άλγος λόγω κακοήθειας στην άνω κοιλιακή χώρα ή χρόνια παγκρεατίτιδα [9], όπως παρουσιάζεται σε μετα-ανάλυση 21 αναδρομικών μελετών και μίας προοπτικής και δύο τυχαιοποιημένων, ελεγχόμενων ερευνών, όπου παρείχαν καλή έως εξαιρετική ανακούφιση του πόνου στο 89% των ασθενών κατά τις πρώτες 2 εβδομάδες μετά τη θεραπεία. Η μακροχρόνια παρακολούθηση πέραν των 3 μηνών αποκάλυψε συνεχές όφελος [10]. Άλλες μελέτες παρείχαν θετικά αποτελέσματα σε ανθεκτικό νευροπαθητικό πόνο στο θώρακα που σχετίζεται με καρκίνο ή χειρουργική επέμβαση, όπου ο νευρικός αποκλεισμός φάνηκε επίσης να είναι μια πολλά υποσχόμενη θεραπευτική επιλογή [13], καθώς και σε πόνο που σχετίζεται με κακοήθειες της πυέλου. Η τεχνική αυτή μπορεί να είναι μια πολύτιμη εναλλακτική λύση και στη θεραπεία του νευρώματος Morton, όπως έχουν αποδείξει αρκετές μελέτες [17], ή στη θεραπεία της παραισθητικής μεραλγίας [18].
Οι μη επεμβατικές τεχνικές διακρανιακής εγκεφαλικής διέγερσης αποτελούν μια θεραπευτική προσέγγιση χρήσιμη σε ασθενείς με ανθεκτικό νευροπαθητικό πόνο και περιλαμβάνουν την επαναλαμβανόμενη διακρανιακή μαγνητική διέγερση (rTMS) και τη διακρανιακή διέγερση συνεχούς ρεύματος (tDCS). Η rTMS παράγει ηλεκτρικά ρεύματα στον φλοιό του εγκεφάλου μέσω ενός παροδικού μαγνητικού πεδίου9 και σε μελέτη πόνου μέλους φαντάσματος (PLP) σε θύματα ναρκοπεδίων έδειξε την ικανότητά της για σημαντική μείωση του πόνου έως και 15 ημέρες μετά τη θεραπεία. Άλλη κλινική δοκιμή έδειξε τη χρήση επαναλαμβανόμενης μαγνητικής διέγερσης της σπονδυλικής στήλης (SMS) ως θεραπευτική επιλογή σε ασθενείς με ανθεκτικό νευροπαθητικό πόνο στα κάτω άκρα. Το αναλγητικό αποτέλεσμα ήταν εμφανές αμέσως μετά τη θεραπεία με θετικό αποτέλεσμα έως και 4 ημέρες μετά τη θεραπεία. Η διέγερση tDCS έχει αναφερθεί ότι έχει ευεργετική επίδραση στη θεραπεία του νευροπαθητικού πόνου που σχετίζεται με τον διαβήτη, και το σύνδρομο ινομυαλγίας.
Μια άλλη εναλλακτική θεραπεία χρήσιμη για ασθενείς που δεν ανταποκρίνονται στην τυπική θεραπεία νευροπαθητικού πόνου, αποτελεί η διέγερση σπονδυλικής στήλης (SCS) που είναι μια επεμβατική τεχνική που περιλαμβάνει τη διέγερση των οπισθίων δεματίων νωτιαίου μυελού με χορήγηση ηλεκτρικών παλμών σε συχνότητες περίπου 50 Hz (μέσω εμφυτευμένης γεννήτριας παλμών) που είναι σε θέση να καταστείλει τη κεντρική νευρική υπερδιέρση. Τα ηλεκτρόδια μπορούν να εισαχθούν διαδερμικά μέσω επισκληρίδιας βελόνας ή να εμφυτευθούν χειρουργικά με λαμινοτομή. Η SCS έχει οδηγήσει σε αποτελεσματική θεραπεία σε διάφορες καταστάσεις νευροπαθητικού πόνου.
Σε μελέτη έχει αναφερθεί η ευεργετική επίδραση της SCS σε χρόνιο ανθεκτικό πόνο, συμπεριλαμβανομένου του συνδρόμου αποτυχημένης χειρουργικής εγχείρησης (επέμβασης) (FBSS) και σε καταστάσεις, όπως ινομυαλγία. (11)
Σε πολυκεντρική, διπλά τυφλή, διασταυρούμενη, τυχαιοποιημένη ελεγχόμενη μελέτη όπου συμμετείχαν ασθενείς με επίμονη ή επαναλαμβανόμενη οσφυαλγία με ή χωρίς ίδιο ή μικρότερο πόνο στα πόδια, χρησιμοποιήθηκε SCS υψηλής συχνότητας (1-10 kHz). Στο τέλος της μελέτης διαπιστώθηκε ανακούφιση από τον πόνο μετρημένη με αριθμητική κλίμακα βαθμολογίας, καθώς και βελτίωση της ποιότητας ζωής σε όλες τις χρησιμοποιούμενες συχνότητες. (15)
Σύμφωνα με τ’ αποτελέσματα δύο προοπτικών πολυκεντρικών κλινικών δοκιμών, που συμμετείχαν ασθενείς με επώδυνη διαβητική περιφερική νευροπάθεια (PDPN) σε (ποσοστό) περίπου 50% (των ασθενών), η θεραπεία με SCS μείωσε τα συμπτώματα του χρόνιου πόνου στα κάτω άκρα έως και 5 χρόνια παρακολούθησης. Το 80% των ασθενών με PDPN εξακολουθούν να χρησιμοποιούν τη συσκευή SCS μετά από 5 χρόνια. (17)
Το SCS μπορεί να θεωρηθεί ως έγκυρη, αποτελεσματική και ασφαλής επιλογή θεραπείας σε ασθενείς που πάσχουν από νευροπαθητικό πόνο και είναι ανθεκτικοί στη φαρμακολογική θεραπεία.
Συμπεράσματα
Η τρέχουσα φαρμακευτική θεραπεία του νευροπαθητικού πόνου έχει συχνά χαμηλή αποτελεσματικότητα, ενέχει τον κίνδυνο ανεπιθύμητων ενεργειών και επηρεάζει αρνητικά την ποιότητα ζωής των ασθενών. Η αναζήτηση αποτελεσματικότερων φαρμάκων με λιγότερες ανεπιθύμητες ενέργειες απαιτείται προκειμένου να εξασφαλιστεί η συμμόρφωση των ασθενών και να βελτιωθεί η αντιμετώπισή τους. Τα καναβινοειδή δημιουργούν ελπίδες αλλά δεν παύουν να εμπνέουν φόβο. Η παλμιτοεθανολαμίδη φαίνεται να συνδυάζει ασφάλεια, αποτελεσματικότητα, συμμόρφωση και ικανοποιητική σχέση κόστους οφέλους.
truemed